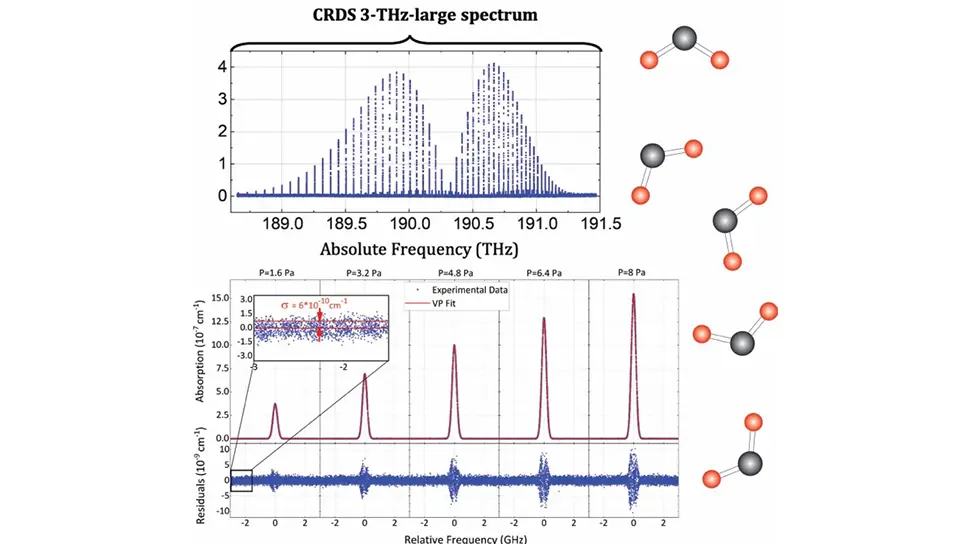
Molte malattie umane, incluso il cancro, hanno origine da complessi cambiamenti biochimici che iniziano in profondità all'interno delle cellule. Nel tempo, queste piccole alterazioni si accumulano, portando alla formazione di tumori altamente variabili nella loro composizione—un fenomeno noto come eterogeneità tumorale. Ciò significa che un singolo tumore può contenere molti tipi diversi di cellule, ciascuno potenzialmente in grado di rispondere in modo diverso ai trattamenti. Questa policlonalità delle cellule tumorali rappresenta una sfida importante. Complica sia la diagnosi che la terapia, poiché alcuni cloni cellulari possono resistere al trattamento e diffondersi in altre parti del corpo (metastasi). Per combattere questo fenomeno, i medici hanno bisogno di strumenti precisi in grado di identificare ciascuno di questi cloni unici in una biopsia tumorale. In questo modo, possono somministrare terapie personalizzate progettate specificamente per le caratteristiche del tumore di quel paziente—migliorando i risultati e aumentando i tassi di sopravvivenza.
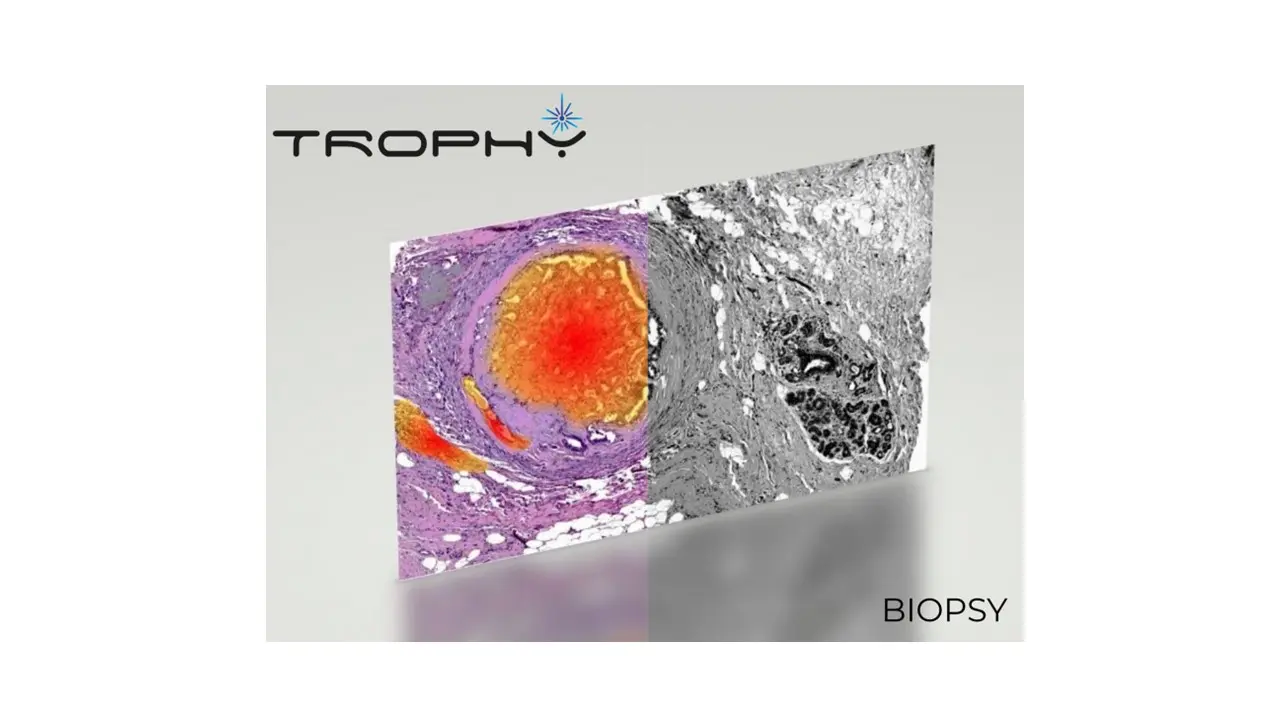
Per affrontare questa sfida, nel progetto COSMOS lavoriamo all’introduzione di una nuova tecnica chiamata ulTRafast hOlograPHic FT-IR microscopY, che dà anche il nome a un progetto europeo Pathfinder guidato da POLIMI (TROPHY). TROPHY unisce diverse tecnologie in uno strumento unico che combina l’imaging iperspettrale nella regione delle impronte molecolari—la più ricca in termini di dettagli spettrali—con una risoluzione sub-cellulare, ovvero:
• Microscopia a infrarossi foto-termica (PT-IR): TROPHY prende in prestito l’idea di utilizzare la luce infrarossa (IR) per eccitare le vibrazioni molecolari e un laser nel visibile per rilevarle, ottenendo così un’elevata risoluzione spaziale.
• Spettroscopia a trasformata di Fourier (FT-IR): Utilizza l’interferometria nel dominio del tempo per analizzare l’intero spettro delle vibrazioni IR, permettendo un’elevata risoluzione spettrale.
• Microscopia olografica digitale (DHM): Da questa tecnologia, TROPHY trae la capacità di rilevare in campo largo e con alta risoluzione temporale piccoli cambiamenti nell’indice di rifrazione—cioè la “impronta ottica” delle strutture molecolari.
Lo sviluppo di questo strumento comporta numerosi aspetti interdisciplinari, tra cui: i) progettazione e ottimizzazione di una sorgente IR a femtosecondi ultra-broadband, che copra l’intervallo 5,5–10 µm, fondamentale per accedere alla regione delle impronte molecolari; ii) sincronizzazione dell’eccitazione IR con un fascio laser nel visibile e una rilevazione basata su telecamera, per consentire misurazioni ultraveloci risolte nel tempo; iii) allineamento e messa a punto di un microscopio olografico digitale personalizzato, essenziale per acquisire immagini di fase sensibili e ad alta risoluzione; iv) acquisizione e analisi di dataset iperspettrali in un ampio spettro di condizioni di eccitazione e rilevamento, per ottimizzare sistematicamente il rapporto segnale-rumore; v) selezione e preparazione di campioni organici e inorganici, inclusi tessuti biologici, per valutare il sistema in diversi ambiti applicativi; vi) implementazione di algoritmi avanzati di elaborazione delle immagini, inclusa l’imaging differenziale e l’analisi basata sulla trasformata di Fourier, per estrarre informazioni chimiche quantitative; vii) studio della fisica sottostante ai cambiamenti di fase transitori indotti dall’eccitazione IR coerente, elemento centrale del meccanismo di TROPHY; viii) confronto del metodo TROPHY con le tecniche convenzionali esistenti, per validarne i miglioramenti in termini di risoluzione spaziale, spettrale e temporale; ix) collaborazione stretta con biologi e ricercatori medici, in particolare per l’analisi delle biopsie tumorali, affinché il sistema soddisfi le esigenze reali della diagnostica clinica.